Тяжёлый металл, коим является кобальт, открыл шведский химик Г. Брандт в 1735 году. В то время перед металлургами стояла задача более глубокого очищения добываемых руд для повышения качества выплавляемой стали. Серебристое вещество с розовым оттенком первоначально назвали кобольдом. Спустя десятилетия за этим металлом закрепилось название кобальт.
Кобальт: физические и химические свойства
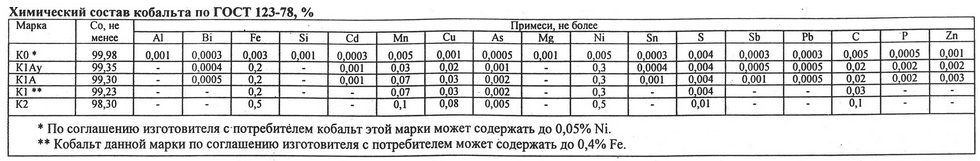
Химсостав металлического кобальта, выпускаемого в слитках, стандартизирован ГОСТом 123-78:
Данный элемент устойчив в простых соединениях, относительно стоек по отношению к воздуху и воде (в нормальных условиях). При этом он начинает окисляться на воздухе при t=300оС. После нагревания кобальт соединяют с галогенами для получения галогенидов. Что же касается взаимодействия металла с соляной и серной кислотами, то при таком воздействии кобальт медленно растворяется, выделяя водород и трансформируясь в хлорид кобальта (СоCl2) и сульфат кобальта (CoSO4). Если же данное вещество погрузить в азотную кислоту, удастся получить нитрат – Co(NO3)2.
Следующая таблица поможет сравнить физические свойства Со с такими металлами, как железо (Fe) и никель (Ni):
Магнитные свойства кобальта
Этому металлу свойственна способность сохранять намагниченность. В результате, кобальт становится непременным «участником» магнитных сплавов, имеющих относительно высокое сопротивление к размагничиванию. Более того, именно Со делает магниты устойчивыми к изменениям температур и вибрациям, делая при этом изделие доступным для механической обработки.
Основное применение магнитных сплавов на основе кобальта отмечается в изготовлении разнообразной электротехнической продукции: трансформаторы, сердечники электрических двигателей и т.д. Отличным примером превосходных магнитных свойств Со можно считать японскую сталь: 60-процентное содержание кобальта придаёт стойкость к размагничиванию, равную лишь 2-3% при самых сильных вибрациях.
Кобальт: применение
Металл кобальт является легирующим, поэтому основное своё применение он находит при создании различных сплавов. В частности, он существенно улучшает жаропрочные свойства сталей, их износоустойчивость и твердость, повышает вязкость металла и снижает чувствительность сплава к вибрациям, ударам и толчкам. При этом, оксид кобальта 2 – отличный катализатор для химических реакций.

Благодаря своим уникальным химическим и физическим характеристикам кобальт востребован и авиационной, и космической промышленностью, где постепенно заменяет никель (при t>1038°С никелевый сплав теряют в прочности, чего не скажешь о металлах с примесями кобальта).
Отдельное направление, где фигурирует кобальт – применение в медицине. Этому элементу доверяют работу по синтезу мышечных белков, активизации ферментов, повышению гликолитической активности крови, стимулированию кроветворения. Такие препараты, как коамид, кобальтамин, кобальтин или ферковен, содержат в своей основе кобальт и помогают стимулировать эритропоэз при анемиях.